|
|
| FORMULARIO DE QUÍMICA |
|
EQUILIBRIO QUÍMICO |
||
|
REACCIONES REVERSIBLES Y EN FASE HOMOGÉNEA |
||
|
a A + b B <==> c C + d D |
||
| Cte de equilibrio referida a la presión |
|
Px : Presión Parcial del gas X ∆Go : Energía libre estándar de Gibbs R : Cte de gas perfecto T : Temperatura (K) |
| Cte de equilibrio referida a las concentraciones |
 |
[X] : Concentración de X (moles/litro) ∆n : moles productos - moles reactivos = (c + d) - (a + b) Si ∆n=0 entonces Kp=Kc |
| Cte de equilibrio referida a las fracciones morales |
 |
P : Presión total PA = xA·P xA : Fracción molar de A ( = moles de A / moles totales) |
| Reacciones entre sólidos y líquidos |
 |
a A(s) + b B (aq) <==> c C(s) + d D (aq) |
| Reacciones entre sólidos y gases |
 |
a A(s) + b B (g) <==> c C(g) + d D (g) |
| Reacciones entre líquidos y gases |
 |
a A(l) + b B (g) <==> c C(g) + d D (l) |
|
VARIACIÓN DE ENTALPÍA LIBRE DE UNA REACCIÓN REVERSIBLE |
||
| Entalpía libre (Gibbs) |
 |
PCc · PDd Q = ———— PAa · PBb Q : (cociente de reacción) |
| Entalpía libre (Gibbs) |
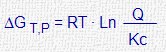
|
[C]c · [D]d Q = ———— [A]a · [B]b Q : (cociente de reacción) |
| Reacción en equilibrio | Si Q = Kp (o Q = Kc) | |
| Reacción evoluciona hacia <= | Si Q > Kp (o Q > Kc) | |
| Reacción evoluciona hacia => | Si Q < Kp (o Q < Kc) | |
| Ecuación de Van't Hoff |
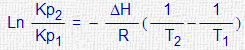 |
∆H : Variación de entalpía de la reacción |
|
LEY DE LE CHATELIER |
||
| La presión | Si un sistema se encuentra en fase gaseosa y la presión total aumenta, el sistema evolucionará espontáneamente, originándose sustancias que ocupen menor volumen, y de volumen mayor en caso contrario. | |
| El volumen | Si se aumenta el volumen, el equilibrio se desplazará en el mismo sentido que lo haría con una disminución de presión. Si se disminuye el volumen, el equilibrio se desplaza en el mismo sentido que lo haría con un aumento de presión | |
| La concentración | Un aumento de la concentración de los reactivos o una disminución de la de los reactivos desplaza el equilibrio hacia la derecha, mientras que una disminución de la concentración de los reactivos o un aumento de la de los productos, lo desplaza hacia la izquierda. | |
| La temperatura | Un aumento de temperatura favorece una reacción de equilibrio en sentido endotérmico; una disminución de temperatura, en el sentido exotérmico. | |