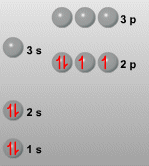
En condiciones normales de presión y temperatura, el
oxígeno se encuentra en estado gaseoso formando moléculas
diatómicas (O2) que a
pesar de ser inestables se generan durante la fotosíntesis
de las plantas y son posteriormente utilizadas por los
animales en la respiración. Existe una forma molecular formada por
tres átomos de oxígeno, O3,
denominada ozono cuya presencia en la atmósfera protege la Tierra
de la incidencia de radiación ultravioleta procedente del Sol.
Es el elemento más abundante de la corteza terrestre (un 46,7% estimado), y de los océanos (en torno al 87% como componente del agua) y el segundo en la atmósfera (cerca del 20%).
Es el elemento más abundante de la corteza terrestre (un 46,7% estimado), y de los océanos (en torno al 87% como componente del agua) y el segundo en la atmósfera (cerca del 20%).